Deborah Moreira / Comunicação SEESP
O Brasil foi procurado por cinco iniciativas internacionais - Universidade de Oxford (Inglaterra); Sinovac Biotech (China); Gamaleya (Rússia); Janssen Pharmaceuticals, do grupo Johnson & Johnson (Estados Unidos); e a colaboração tripartite entre BioNTech (Alemanha), Pfizer (EUA) e Fosun Pharma (China) - para executar a etapa clínica final de desenvolvimento de vacinas contra o novo coronavírus, causador da Covid-19 (Sars-Cov-2). A fase 3, como é conhecida na área da pesquisa, já está em andamento em algumas cidades brasileiras nos estados da Bahia, Minas Gerais, Paraná, Rio de Janeiro, Rio Grande do Norte, Rio Grande do Sul e São Paulo.
 Produção de vacinas na Fiocruz atrai parceria com laboratório inglês da Universidade de Oxford. (Crédito: Bernardo Portella-Divulgação Fiocruz)
Produção de vacinas na Fiocruz atrai parceria com laboratório inglês da Universidade de Oxford. (Crédito: Bernardo Portella-Divulgação Fiocruz)
Para o biólogo Eduardo Ramos Sanchez, imunólogo pesquisador do Instituto de Medicina Tropical da Universidade de São Paulo (IMTSP-USP), o Brasil foi procurado pelas fabricantes por reunir um conjunto de requisitos fundamentais para os testes. Entre eles, dispor de estrutura para a produção em larga escala, garantida pela Fundação Oswaldo Cruz (Fiocruz) e pelo Instituto Butantan, e distribuição com alta capilaridade, por meio do Sistema Único de Saúde (SUS). Outro ponto importante é sua variabilidade genética, o que aumenta a precisão nos resultados e amplia as possibilidades de aplicação em outros países. E, por fim, por estar entre nações com maior número de pessoas contaminadas, com a curva de contágio alta – até o mês de agosto, são quase 4 milhões de brasileiros infectados e 121.515 óbitos.
Parcerias
Uma das vacinas aprovadas pela Agência Nacional de Vigilância Sanitária (Anvisa) para ser testada no País é a do Laboratório AstraZeneca, da Universidade de Oxford, que firmou parceria com a Fiocruz. O acordo prevê transferência de tecnologia para a formulação do ingrediente farmacêutico ativo e produção de 100 milhões de doses, caso seja comprovada eficácia e segurança. Os testes estão sendo monitorados pela Universidade Federal de São Paulo (Unifesp) e pelo Instituto D’Or de Pesquisa e Ensino. A previsão é que as primeiras doses estejam prontas no início de 2021 para serem enviadas à Anvisa para o processo de certificação, segundo informa Akira Homma, assessor científico sênior do Instituto de Tecnologia em Imunobiológicos da Bio-Manguinhos - unidade da Fiocruz responsável pela pesquisa, inovação e produção de vacinas, entre outras atividades. Para tanto, reúne cerca de 1,7 mil profissionais, entre eles engenheiros. “Será fundamental a atuação de diversas áreas da engenharia para garantir as operações de processamento final do ingrediente farmacêutico ativo, que consiste na primeira etapa a ser realizada, além das adequações necessárias à incorporação da tecnologia”, salienta Homma.
Serão produzidas 30,4 milhões de doses, ao custo de US$ 127 milhões, antes do término dos ensaios clínicos. Com a conclusão destes e eficácia comprovada da vacina, haverá a produção de mais 70 milhões de doses. A unidade afirma ter capacidade para o processamento de até 40 milhões ao mês, considerando rearranjo dos turnos de trabalho.
“É preciso aguardar os resultados dos estudos clínicos e o registro da vacina junto à Anvisa para que possa ser aplicada com segurança na população. Está previsto que Bio-Manguinhos receba a primeira remessa do ingrediente farmacêutico ativo em dezembro próximo, para realizar as etapas de processamento final: formulação, envase, rotulagem e embalagem, além do controle de qualidade”, explica Homma.
Desenvolvimento, aplicação e dosagem
Desenvolvida em uma plataforma de vírus não replicante (que não se reproduz), usa-se uma versão mais branda de um adenovírus (conjunto de vírus) causador de uma gripe comum em chimpanzés, chamado CHAdOx1. Este foi geneticamente modificado para não causar infecções em pessoas e para fazer as células produzirem a proteína Spike (S), que compõe o Sars-Cov-2 e permite sua ligação aos receptores das células humanas, possibilitando a infecção.
Embora seja baseada em uma nova tecnologia, a plataforma já foi testada em surtos de Ebola e Mers (síndrome respiratória que ficou conhecida do Oriente Médio, causada por outro tipo de coronavírus). Além disso, é semelhante a plataformas utilizadas pela Bio-Manguinhos, o que, na avaliação do assessor científico dessa unidade, agilizará a transferência de tecnologia com tempo reduzido.
A vacina será intramuscular, e ainda não há uma definição de quantas doses serão necessárias para a imunização e por quanto tempo surtirá efeito no organismo. “É preciso aguardar o resultado dos estudos clínicos no Brasil e demais países onde a pesquisa está sendo realizada”, pondera Homma.
 Vacina Sinovac / DivulgacaoCoronaVac
Vacina Sinovac / DivulgacaoCoronaVac
Outra opção testada no País é a da empresa privada chinesa Sinovac, denominada CoronaVac, em parceria com o Instituto Butantan. Os testes da fase 3 no Brasil se iniciaram em julho último, com previsão de participação de 9 mil voluntários nos estados de São Paulo, Rio Grande do Sul, Paraná, Rio de Janeiro, Minas Gerais e Brasília.
Se a vacina for aprovada, a Sinovac e o Butantan poderão firmar acordo de transferência de tecnologia para produção em escala industrial tanto na China quanto no Brasil para o fornecimento gratuito ao SUS.
Segundo o Butantan, que criou um hotsite específico sobre a vacina, a plataforma usada é feita com o novo coronavírus cultivado em células Vero (linhagem estabelecida em 1962 a partir da extração em rins de macacos-verdes africanos e usada como modelo de pesquisa pela Organização Mundial da Saúde - OMS). Inativado para que não possa contaminar o organismo, é acrescentado a ele hidróxido de alumínio, substância conhecida como adjuvante (que reforça a ação) para que a vacina gere anticorpos na pessoa. Estão previstas a aplicação, via muscular, de duas doses com intervalo de 14 dias. “É considerada segura porque usa o vírus inativado, tecnologia amplamente testada”, destaca o biólogo Miguel Malpartida.
A Sinovac anunciou que espera produzir 100 milhões de doses até o final deste ano. Segundo o governador de São Paulo, João Doria, a CoronaVac pode estar disponível em janeiro do ano que vem, se os resultados antecipados forem satisfatórios.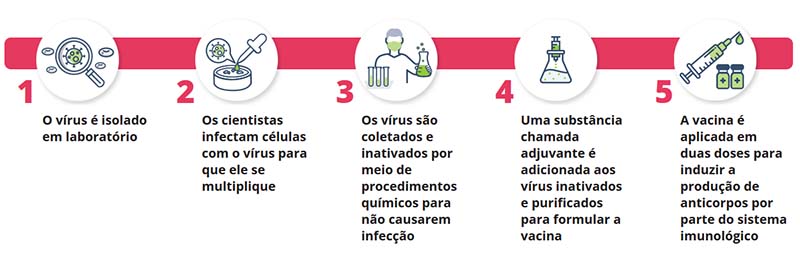 Etapas do desenvolvimento da CoronaVac. (Imagem: Governo do Estado de São Paulo)
Etapas do desenvolvimento da CoronaVac. (Imagem: Governo do Estado de São Paulo)
Outros testes no País
A BNT162b1, resultado de uma colaboração tripartite entre as empresas alemã BioNTech, americana Pfizer, e chinesa Fosun Pharma, vem sendo testada desde o final de julho último com 30 mil voluntários no Brasil, Estados Unidos, Argentina e Alemanha. O governo dos EUA comprou 100 milhões de doses por US$ 1,9 bilhão, com a opção de adquirir mais 500 milhões posteriormente. O Japão garantiu 120 milhões para sua população. A expectativa é que mais de 1,3 bilhão de doses sejam fabricadas até o final de 2021.
A quarta vacina autorizada, no dia 18 de agosto último, a realizar testes em brasileiros é a Ad26.COV2.S, desenvolvida pela Janssen Pharmaceuticals, do grupo Johnson & Johnson. O início ainda depende de aprovação no Conselho Nacional de Ética em Pesquisa (Conep) – órgão do Ministério da Saúde responsável pela avaliação ética de pesquisas clínicas – e do tempo para recrutamento dos voluntários. Está prevista a participação de 7 mil pessoas em sete estados: Bahia, Minas Gerais, Paraná, Rio de Janeiro, Rio Grande do Norte, Rio Grande do Sul e São Paulo. Em todo o mundo, a empresa pretende testar 60 mil pessoas. As primeiras etapas (1 e 2) começaram em julho, nos Estados Unidos e na Bélgica.
 Sputnik V
Sputnik V
A vacina russa, denominada Sputnik V, desenvolveu uma plataforma similar à da Oxford, porém usando dois adenovírus modificados e não replicantes em células humanas, ao invés de um. Denominados Ad26 e Ad5, ambos contêm o gene da proteína S (presente no organismo humano e que tem servido de porta de entrada para o novo coronavírus). Essa tecnologia já estava em desenvolvimento no Centro de Pesquisa Gamaleya do governo russo para a formulação de vacinas contra Ebola e Mers. A estratégia consiste em duas etapas de vacinação: a primeira com o Ad26 e a segunda, após 21 dias, com o Ad5. A ideia é induzir uma resposta imune de maneira preferencial contra a proteína S.
“Teoricamente, seria uma vantagem técnica e metodológica em relação às outras vacinas. No entanto, falta transparência na divulgação dos estudos das fases 1 e 2, que aparentemente teriam sido iniciados há dois meses, com apenas 38 indivíduos. Além disso, o desenvolvimento da vacina só foi colocado no site web Clinical Trials no dia 12 de agosto, um dia após o anúncio do início da fase 3”, comenta o imunólogo Eduardo Ramos.
Para ele, a Sputnik V é uma vacina em desenvolvimento ainda, já que não há como avaliar o sucesso da aplicação desses dois vetores virais e comprovar a eficácia da resposta imune em humanos. A realização da fase 3, concomitantemente com a fabricação e distribuição, ignora a possibilidade de efeitos e fenômenos já citados.
Contudo, alguns estados mostraram interesse em realizar tais estudos clínicos. No dia 12 de agosto, os governos do Paraná e da Rússia assinaram documento para o desenvolvimento da vacina. Deverá ser criado um grupo de trabalho para o compartilhamento dos resultados das fases 1 e 2. A previsão é de que os testes ocorram no estado do sul do Brasil. Os detalhes ainda estão sendo negociados, como transferência de tecnologia e produção.
Sabe-se, a partir dos registros de historiadores, que a Rússia herdou da antiga União Soviética um dos maiores centros de pesquisas, especializado em armas biológicas. Assim, reuniu cepas e antídotos dos mais variados, principalmente durante a Guerra Fria (1947-1991), quando foi construído o Instituto Vector, que serviu como centro de pesquisas para o extinto programa soviético de armas biológicas, armazenando amostras de vírus do Ebola, HIV, antrax e varíola.